Programme ER-004 sur la dysplasie ectodermique hypohidrotique liée à l'X (XLHED)
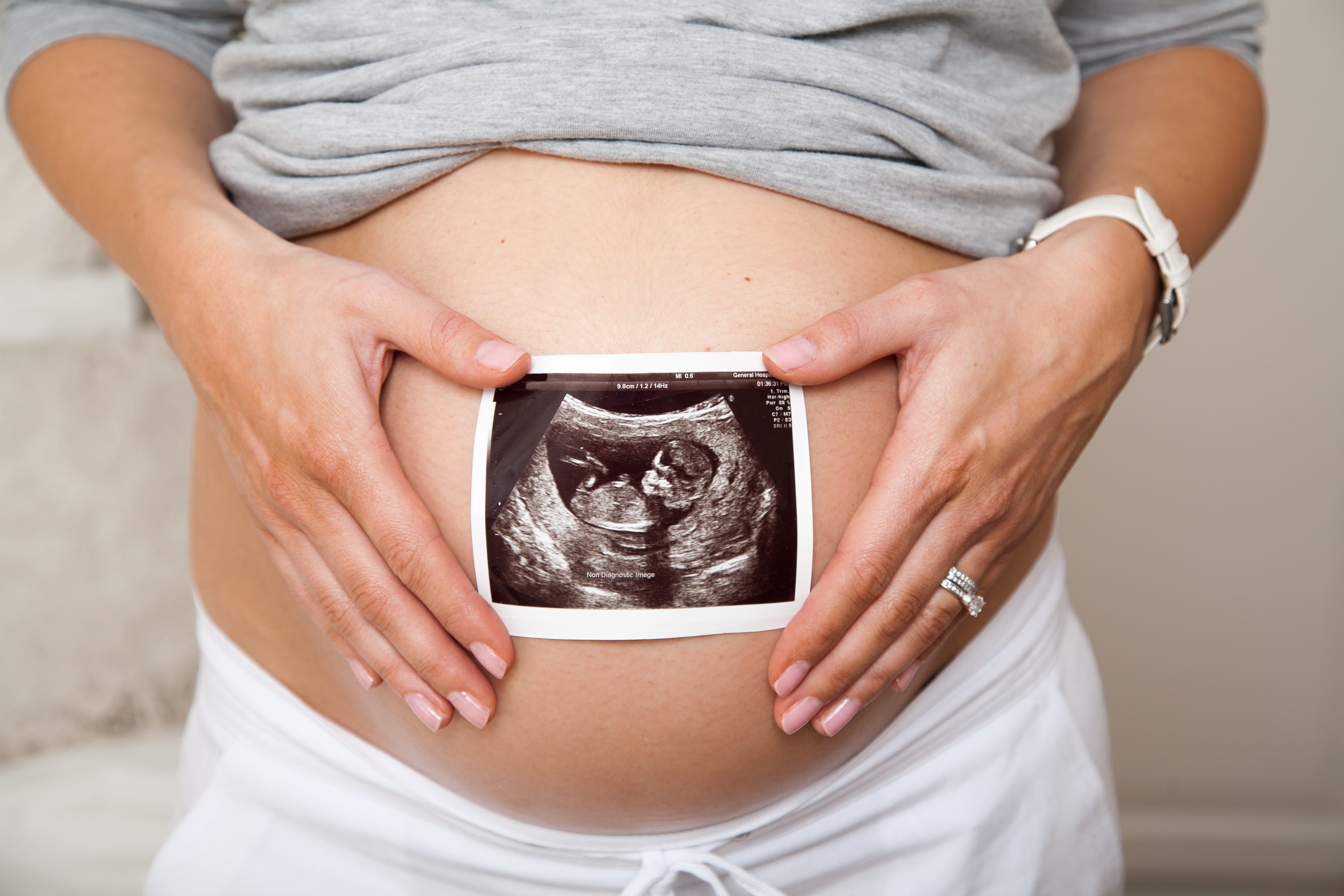
ER-004 : Une thérapie qui peut induire un développement ectodermique normal avec une administration thérapeutic in utero

La protéine ER-004 constitue une thérapie novatrice visant à remplacer la fonction de l'ectodysplasine-A1 (EDA1) endogène. Cette thérapie de remplacement des protéines agit comme un substitut de la protéine EDA1 qui déclenche le développement de structures ectodermiques clés telles que les glandes, les dents et les cheveux. Administré avant la naissance - ER-004 vise à rétablir un développement de l'ectoderme normal chez les patients atteints d'une dysplasie ectodermique liée à l'X (XLHED).
Avant d'être repris par EspeRare, ce traitement a été conçue à Lausanne, en Suisse, et développée initialement par Edimer Pharmaceuticals, une société de biotechnologie basée aux États-Unis.
ER-004 est le premier et le seul traitement en développement pour le XLHED
Administré au bon moment dans le développement, ER-004 à le potentiel de devenir un traitement qui corrige efficacement les symptômes de la maladie tout au long de la vie des patients grâce à un traitement durant développement foetal. Cette approche a déjà démontré un potentiel significatif en corrigeant la fonction des glandes sudoripares chez trois patients soumis à ce protocole par le professeur Holm Schneider à l'Hôpital universitaire d'Erlangen en allemagne. Les premiers résultats ont été publiés dans les revues New England Journal of Medicine [1] et British Journal of Clinical Pharmacology [2], ainsi que dans la rubrique Research Highlights de Nature Medicine [3].
Fin 2020, EspeRare et le groupe Pierre Fabre ont convenu d'un accord afin de développer ER-004 en vue de sa commercialisation en tant que traitement prénatal de la XLHED. Ensemble, EspeRare et Pierre Fabre initient actuellement un essai clinique qui vise à mettre ER-004 sur le marché dans l'UE et aux États-Unis. En tant que partenaires, ils s'engagent à respecter une charte éthique qui régit leur relation et place la communauté des patients XLHED au cœur du développement d'ER-004. (lien vers le communiqué de presse)
Aux États-Unis, en plus de cette thérapie révolutionnaire de la FDA, le programme bénéficie de la procédure accélérée et de la désignation de médicament orphelin. En Europe, le programme bénéficie de l'appui du programme PRIME (Priority Medicines) de l'EMA et de la désignation de médicament orphelin. Grâce à ces multiples avantages réglementaires, le programme peut viser un développement mondial simplifié.
L'essai clinique EDELIFE est en cours de recrutement
En 2021, EspeRare et le groupe Pierre Fabre ont lancé l'essai clinique EDELIFE qui vise à commercialiser le traitement ER-004 dans l'UE et aux États-Unis en 2027. L'objectif de l'essai clinique EDELIFE est de confirmer la sécurité et l'efficacité d'ER-004, administré comme traitement prénatal aux garçons atteints de XLHED.
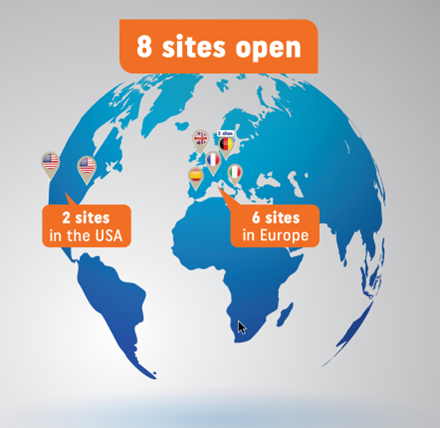
L'hôpital universitaire d'Erlangen en Allemagne a été le premier site d'investigation à ouvrir le recrutement de femmes enceintes d'un garçon atteint de XLHED, avec le professeur Holm Schneider comme investigateur principal. D'autres sites d'investigation sont désormais ouverts à Leipzig (Allemagne), Paris (France), Murcie (Espagne), Milan (Italie), Cardiff (Royaume-Uni), Saint Louis, MO (États-Unis) et Los Angeles, CA (États-Unis), ce qui porte à huit le nombre total de sites pour l'essai clinique EDELIFE, répartis dans six pays.
Les familles touchées par la XLHED qui souhaitent en savoir plus sur la participation à l'essai clinique EDELIFE peuvent consulter le site www.clinicaltrials.gov. Ce site web est la source d'informations sur la description de l'étude, sa conception, les critères d'éligibilité, et fournit les coordonnées des investigateurs et des représentants des patients.
En collaboration avec les patients XLHED
EspeRare considère que l'engagement continu de la communauté des patients est essentiel pour le succès du programme ER-004. La fondation reconnaît également que la communauté des patients a déjà largement contribué à faire progresser les connaissances sur cette maladie génétique (par exemple, en collectant des données sur l'histoire naturelle et en fournissant des informations sur la caractérisation de la maladie et les besoins médicaux non satisfaits).
EspeRare et ses partenaires sont très reconnaissante envers les familles qui ont partagé leur témoignages en recevant un traitement in-utero pour leurs enfants atteints de XLHED.
"Il y a eu beaucoup de larmes. Mais je savais qu'il s'agissait d'un petit sacrifice à court terme pour que mon fils puisse bénéficier d'un changement à vie" - explique Emily, qui s'est engagée dans un voyage à travers l’Atlantique pour sauver son fils de crises d’hyperthermies sévères et des problèmes respiratoires, qui sont des symptômes potentiellement mortels, en particulier pour les jeunes patients XLHED. Pour en savoir plus sur l'histoire des Nelson, suivez le lien.
Références :
- [1] Prenatal Correction of X-Linked Hypohidrotic Ectodermal Dysplasia. Schneider H, Faschingbauer F, Schuepbach-Mallepell S, Körber I, Wohlfart S, Dick A, Wahlbuhl M, Kowalczyk-Quintas C, Vigolo M, Kirby N, Tannert C, Rompel O, Rascher W, Beckmann MW, Schneider P. N Engl J Med 2018; 378: 1604-1610
- [2] Safety and immunogenicity of Fc-EDA, a recombinant ectodysplasin A1 replacement protein, in human subjects. Körber I, Klein OD, Morhart P, Faschingbauer F, Grange DK, Clarke A, Bodemer C, Maitz S, Huttner K, Kirby N, Durand C, Schneider H. Br J Clin Pharmacol. 2020;86(10):2063-2069
- [3] In utero correction of a genetic disorder. Stower H. Nature Medicine 2018; 24: 702
ER-004: Avantages attendus pour les patients
- Capacité de transpiration restaurée:
- > Moins de crises fébriles
- > Moins de risques de lésions cérébrales
- > Réduction de la mortalité infantile
- > Moins d'infections respiratoires
- > Moins de problèmes occulaires
- Amélioration de la structure osseuse de la mâchoire et des dents:
- > Possibilité d'implants dentaires
- > Une meilleure alimentation
A propos de la dysplasie ectodermique hypohidrotique liée à l'X (XLHED)
XLHED est une maladie génétique rare qui affecte les structures ectodermiques, notamment les glandes sudoripares, les glandes respiratoires, la peau, les cheveux et les dents. Les manifestations cliniques de la XLHED sont graves et peuvent inclure des épisodes d'hyperthermie potentiellement mortels, une intolérance à la chaleur et un risque accru d'infections graves des voies respiratoires. Il n'existe actuellement aucune thérapie approuvée pour le traitement de la XLHED et la norme actuelle de soins est uniquement palliative.
Les garçons ayant une seule copie de ce gène sur leur unique chromosome X, présentent généralement tout le spectre de symptômes de cette maladie, contrairement aux filles qui sont en général moins touchées.
La XLHED est une maladie invalidante et potentiellement mortelle au cours des premières années de vie, lorque les nourrissons sont exposés à de hyperthermies et/ou des infections respiratoires sévères.
Lien vers plus d'informations "à propos de XLHED".
ER-004 - USAGE COMPASSIONEL/EXPANDED ACCESS POLICY en XLHED
Expanded Access/usage compassionnel fait référence à l'utilisation d'une thérapie expérimentale, en dehors d'un essai clinique, pour les patients atteints de maladies ou d'affections graves ou mettant leur vie en danger et qui ne disposent pas d'alternatives thérapeutiques. Une thérapie expérimentale, est un médicament qui n'a pas encore été approuvé par les organismes gouvernementaux de réglementation.
La mission d'EspeRare est de faire progresser les traitements pour les maladies rares et de promouvoir l'accessibilité aux traitements par une approche centrée sur le patient.
En conséquence, un Comité consultatif des patients (PAC) consacré au programme XLHED a été établi et donne l'occasion à EspeRare et aux représentants des groupes de patients de travailler en étroite collaboration. Les plans de développement clinique sont discutés afin d'affiner le développement pour générer des données solides et nécessaires à un enregistrement du traitement, et afin de contribuer à l'objectif commun de donner la plus grande chance de succès à ce programme, tout en maximisant les bénéfices et minimisant les risques pour les patients XLHED et leurs familles.
Les demandes d’Usage Compassionel/Expanded Access seront examinées au cas par cas, conformément aux réglementations applicables et à notre mission et à nos valeurs et en accordant la priorité à la sécurité du patient et de la mère. Il est à noter que le traitement ER-004 est administré au patient avant la naissance par injection dans le liquide amniotique, une voie d'administration non éprouvée qui nécessite d’examiner attentivement chaque cas individuellement.
Les demandes de renseignements concernant l’Usage Compassionnel peuvent être envoyées à info.er004@esperare.org
EspeRare s'efforcera d'accuser réception de toute question ou demande d'accès élargi dans un délai de 5 jours ouvrables.