EspeRare a conclu un partenariat avec le groupe Pierre Fabre pour le développement de ER004, une nouvelle thérapie de remplacement protéique in utero pour le traitement de la dysplasie ectodermique hypohidrotique liée au chromosome X (XLHED), une maladie pédiatrique très rare.
Il n'existe actuellement aucun traitement pour l'XLHED et le ER004 pourrait devenir le premier médicament administré in utero à corriger une maladie génétique avant la naissance. Compte tenu des recommandations des agences réglementaires de l'Union Européenne et des États-Unis, les deux partenaires souhaite commencer à recruter, au cours du second semestre 2021, des patientes pour un essai clinique en vue d'une autorisation de mise sur le marché.
Avec le groupe Pierre Fabre, EspeRare a l'avantage de s’allier avec un partenaire qui partage des valeurs communes et des engagements centrés sur le patient.
Selon les termes de l'accord, EspeRare et Pierre Fabre seront co-sponsors de l'étude clinique du ER004 en Europe et aux Etats-Unis, et Pierre Fabre sera responsable de sa commercialisation dans le monde entier. En échange de ces droits commerciaux exclusifs, EspeRare reçoit des revenus financiers. Conformément au modèle à but non lucratif d'EspeRare, ces retours financiers seront d'une part partagés avec les contributeurs initiaux du développement du ER004 et, d'autre part, réinvestis dans la croissance d'EspeRare et le développement de son portefeuille de programmes thérapeutiques.
Eric Ducournau, PDG du groupe Pierre Fabre, a commenté: « Nous sommes fiers de nous allier à la fondation EspeRare afin de trouver une solution thérapeutique à une maladie débilitante qui frappe chaque année 500 bébés dans le monde. Nous ne pouvons pas imaginer une meilleure façon d'incarner notre raison d'être d'entreprise : "Chaque fois que nous prenons soin d'une seule personne, nous rendons le monde meilleur"
Caroline Kant, fondatrice et PDG d'EspeRare, a commenté : "À Esperare, nous sommes ravis de collaborer avec le groupe Pierre Fabre pour co-développer ce programme très inspirant. Nous sommes convaincus qu'en unissant nos forces à celles de Pierre Fabre, nous pourrons proposer cette thérapie révolutionnaire aux patients atteints de XLHED, conformément à nos valeurs axées sur le patient"
Communiqué de Presse
Pour lire l'intégralité du Communiqué de presse en Français et en Anglais.
A propos de XLHED
XLHED est une maladie chronique rare, grave et débilitante. Elle a un impact négatif sur la qualité de vie des patients et de leurs familles. Cette maladie touche environ 4/100 000 naissances de garçons par an. XLHED est causée par des mutations génétiques du gène EDA1, qui donne lieu à la protéine EDA1, une protéine importante dans le développement de l'ectoderme. L'absence d'EDA1 fonctionnelle entraîne un développement anormal de la peau, des glandes sudoripares, des glandes sébacées, des poils, de la cavité buccale et des glandes muqueuses respiratoires, ce qui donne lieu à des manifestations cliniques graves mettant en jeu le pronostic vital dès la naissance, notamment une hyperthermie, des anomalies craniofaciales et des infections respiratoires récurrentes.
A propos de la thérapie
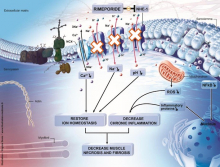
ER004 est une protéine de substitution de la protéine EDA1. La séquence Fc de l'IgG1 humaine est liée au domaine de liaison TNF de l'EDA. Au cours d’essais précliniques, il a été démontré que le ER004 se lie au récepteur EDAR, ce qui entraîne l'activation de la voie de signalisation du NFϰB, et déclenche la transcription de gènes impliqués dans le développement normal de multiples types de tissus ectodermiques. ER004 est le premier et le seul traitement ciblant spécifiquement XLHED. Administré au cours des deuxième et troisième trimestres de la grossesse, il pourrait devenir une thérapie «à traitement unique», améliorant de manière significative les symptômes de la maladie, et ce tout au long de la vie des patients. Ces résultats ont récemment été publiés dans le New England Journal of Medicine et sont parus dans les highlights de l’édition 2018 de Nature Medicine Research.
À propos de PIERRE FABRE
Pierre Fabre est le 2e plus grand groupe pharmaceutique privé français et le 2e plus grand laboratoire de dermo-cosmétique au monde. Son portefeuille est constitué de franchises médicales (oncologie, dermatologie, soins pharmaceutiques) et de marques leaders en dermo-cosmétique (Eau Thermale Avène, Ducray, A-Derma, Klorane, René Furterer, Pierre Fabre Oral Care...). En 2019, Pierre Fabre a réalisé un chiffre d'affaires de 2,4 milliards d'euros, dont les deux tiers à l'international. Basé dans le sud-ouest de la France, le groupe emploie quelque 10 400 personnes dans le monde, possède des filiales ou des bureaux dans 45 pays et distribue ses produits dans plus de 130 pays.
Le groupe Pierre Fabre est détenu à 86 % par la Fondation Pierre Fabre, fondation d'intérêt public reconnue par l'État, tandis que la part restante est détenue par les salariés via un plan d'actionnariat salarié.
En 2019, Ecocert Environnement a évalué la démarche RSE du groupe selon la norme de développement durable ISO 26000 et lui a attribué la note "Excellence" d'Ecocert 26000.
Pour plus d'informations, veuillez consulter le site www.pierre-fabre.com